纳米诊疗体系构建及抗肿瘤机制研究获进展
肿瘤转移被认为是癌症相关死亡的主要原因。光动力疗法(PDT)作为新兴的肿瘤治疗方法,具有时空可控性强、副作用小等优点,可进一步诱导免疫原性细胞死亡,触发生物体的全身免疫反应,有效抑制原发性肿瘤和转移性肿瘤。光敏剂是PDT的核心要素,但目前开发的光敏剂仍有水溶性差、光稳定性不足和选择性差等缺点。
图片来源于网络,侵删
为此,近年来较多研究致力于开发具备成像功能的光敏剂,构建多功能靶向诊断治疗系统,以便改善光敏剂的水溶性、提高光稳定性、增加选择性,最终跟踪纳米颗粒在体内的分布,并对肿瘤进行定位。尽管大量的PDT相关研究被报道,但究竟主要通过哪些重要信号通路发挥作用至今尚不清晰。因此,探究肿瘤治疗PDT的核心通路颇为关键。
近年来,中国科学院化学研究所高分子物理与化学实验室研究员肖海华课题组紧紧围绕生物医用材料和生物安全材料的研究主题,提出了进化纳米医学的研究新思路,开展了纳米药物的多组学研究和靶向肿瘤进化的创新纳米药物的创新研究探索,在铂类药物载体设计、精准递送、示踪成像、可控还原、协同增敏、抑制耐药等方面取得了系列研究进展。
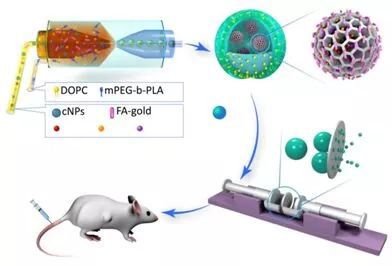
近日,该课题组与德国波鸿鲁尔大学教授Johannes Karges,发展了新型可降解高分子纳米诊疗系统,并用于肿瘤的光动力治疗和免疫治疗。通过在荧光成像分子和光敏剂分子中分别引入羟基官能团,可进一步借助缩合聚合反应,获得主链含有荧光分子、光敏剂的可降解聚合物。该聚合物具有两亲性,在水溶液中可分别自组装成纳米颗粒。为了获得诊疗一体化的纳米颗粒,研究人员将上述两种纳米材料等摩尔混合即可获得复合纳米颗粒(Comp-NPs)。
Comp-NPs经过静脉注射通过EPR效应被动靶向至肿瘤部位,通过光动力疗法和免疫疗法可诱导全身免疫反应,从而抑制肿瘤生长。科研人员通过蛋白质组学研究发现,Comp-NPs抑制了mTOR及其下游P70s6k信号通路。该通路参与肿瘤演变、复发以及转移等关键过程。利用转移性乳腺癌PDX小鼠和肝癌PDX小鼠模型,研究进一步发现Comp-NPs可抑制原发肿瘤的生长并防止肿瘤发生转移。
相关研究成果发表在《自然-通讯》(Nature Communications)上。研究工作得到国家自然科学基金和国家重点研发计划等的支持。
文章摘自网络,侵删
同类文章排行
- 管好这三步,RET融合肺癌患者少走弯路,活得更长更好!
- EGFR突变患者进展了别慌,从耐药检测到治疗选择这样做能找到新出路
- 这种药会降低10倍生存期,请肺癌患者警惕使用!
- 免疫治疗对EGFR突变肺癌有效吗?
- 新型免疫细胞疗法TILS,仅一次治疗为晚期头颈癌患者带来“稳定”的希望!
- 晚期肺癌跨过9年!他坦白秘密:抗癌4大法宝里,这件事最有效
- 演员李菁菁瘦到认不出 曾患乳腺癌如今已战胜病魔
- 临床植入式电极精准定位脑深部肿瘤边界
- 当FDA超级加倍重视OS,能否影响肿瘤药物研发格局?
- 预后极差、治疗选择有限 HER2突变晚期非小细胞肺癌患者迎创新疗法
最新资讯文章
您的浏览历史