我国首个PD-1抑制剂临床研究成果喜人——CheckMate 078中国人群亚组分析证实其安全性、有效性与全球一致性
免疫治疗的问世给癌症治疗带来了一个又一个惊喜。尤其是在肺癌治疗领域,随着新驱动基因的发现和联合治疗的深入尝试,大量临床研究结果相继问世,肺癌治疗也向纵深发展。
在9月21日召开的CSCO肺癌免疫治疗专场报告中,中国抗癌协会肺癌专业委员会主任委员、上海交通大学附属胸科医院肿瘤科主任陆舜教授分享了一组研究分析结果。这项基于关键、III期临床研究CheckMate 078的中国人群亚组分析,不仅确证了PD-1抑制剂在中国人群中的有效性和安全性均优于标准化疗,也进一步证实了与全球临床研究CheckMate 017 和CheckMate 057的一致性。更重要的是,一组组扎实的临床研究结果,为肺癌的免疫治疗提供了强有力的数据,也为后期研究和治疗继续收获更多的惊喜奠定了基础。

陆舜教授在CSCO大会公布
CheckMate 078中国人群亚组分析结果
中国与西方人群差异不大
在中国,每年肺癌新发病例达78.1万例,相当于平均每10分钟就有15人罹患疾病。其中,非小细胞肺癌(NSCLC)是肺癌中最常见的类型,约占所有肺癌患者的85%。
免疫治疗问世后,晚期NSCLC的治疗得到长足发展,两项国际临床研究CheckMate 017和CheckMate 057,即nivolumab(纳武利尤单抗)对照多西他赛治疗晚期二线鳞癌和非鳞癌的III期临床研究,结果显示纳武利尤单抗较多西他赛二线标准治疗方案具有更好的生存获益优势,且安全性好。
该两项研究一经发表就引发了业内的大讨论,引领了晚期NSCLC二线治疗的变革。只是CheckMate 017/057是针对西方人群的,“以前在靶向治疗中,我们过多地强调了人种的差异性,所以亟需证明免疫治疗是否存在人种差异。”陆舜教授说,CheckMate 078中国人群亚组分析进一步证实了纳武利尤单抗与CheckMate 017/057结果一致,确证了在中国人群中对比标准治疗多西他赛具有显著的总生存获益,且东西方人群无显著差异。
安全性、有效性、耐受性均表现惊人
据陆舜介绍,CheckMate 078中国患者亚组共包括451名EGFR/ALK野生型的晚期NSCLC患者,占CheckMate 078研究总体患者数的90%。451名患者中按组织学分型60%为非鳞癌,ECOG(美国东部肿瘤协作组)PS(体力状况)评分为1的患者占87%,共有410名患者可检测PD-L1,其中54%的患者PD-L1表达≥1%。

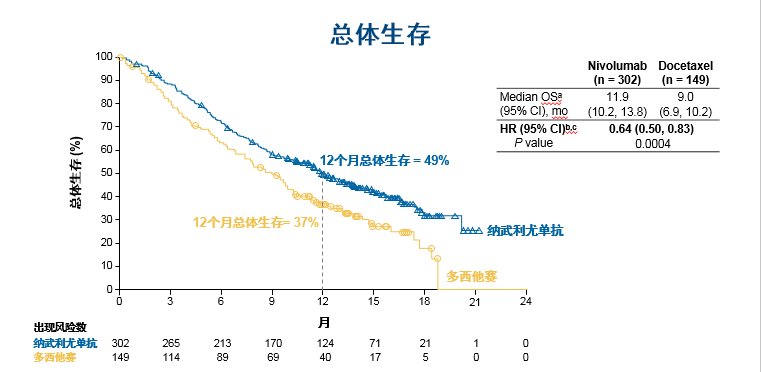
患者接受每两周静脉注射纳武利尤单抗3mg/kg(n=302),或每三周静脉注射多西他赛75mg/m2(n=149),治疗直至疾病进展或发生不可耐受的毒性。研究中最短随访8.8个月,纳武利尤单抗组中位总生存期为11.9个月,多西他赛组为9个月,纳武利尤单抗较多西他赛显著延长患者生存,死亡风险降低36%( HR= 0.64 [95% CI: 0.50, 0.83]; P = 0.0004)。此生存获益在包括按肿瘤组织学和PD-L1表达分析的各亚组间表现一致。两组的客观缓解率分别为17%(纳武利尤单抗)和3%(多西他赛组);纳武利尤单抗组尚未达到中位持续缓解时间(95% CI:9.9,NA),多西他赛组中位持续缓解时间为4.6个月(95% CI: 3.6, 7.1)。与多西他赛相比,纳武利尤单抗显著降低疾病进展风险30%(HR =0.70 [95% CI: 0.56, 0.87]; P = 0.0015)。治疗相关的3-4级副反应事件在纳武利尤单抗组及多西他赛组分别为11%及52%。
开启国内免疫肿瘤治疗时代
截至目前,纳武利尤单抗的临床研发项目已有超过25000名患者入组,研究结果也不断见诸于各大知名医学期刊。值得一提的是,纳武利尤单抗是目前在非小细胞肺癌免疫治疗研究中随访时间最长的PD-1抑制剂,将晚期非小细胞肺癌患者5年生存率由过去的不到5%提高到了16%。
基于强大的研究数据和临床疗效,2014年7月,纳武利尤单抗成为全球首个获得监管机构批准的PD-1免疫检查点抑制剂,目前纳武利尤单抗已在超过65个国家和地区获得批准,全球有超过27万患者获益于纳武利尤单抗的治疗。
CheckMate 078研究又给其在中国上市铺好了道路。2018年 6月15日,纳武利尤单抗获中国国家药品监督管理局正式批准,用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
2018年8月28日,纳武利尤单抗正式登陆中国内地市场。作为国内首个获批上市的免疫肿瘤(I-O)治疗药物,纳武利尤单抗是目前唯一用于肺癌治疗,也是第一个证实能够为中国患者带来显著生存获益的PD-1抑制剂,开启了中国肿瘤免疫治疗时代。
更多适应证有待“解锁”
目前,免疫治疗的进展除了主要新免疫靶点的发现外,与其他治疗方法的联合,甚至是免疫疗法之前的联合也是研究热点。2015年10月,纳武利尤单抗与伊匹木单抗注射液联合治疗转移性黑色素瘤成为首个获得监管机构批准的免疫肿瘤(I-O)药物联合疗法,目前已在超过50个国家和地区获得批准,包括美国和欧盟。
陆舜表示,纳武利尤单抗在全球已经获批17个适应症,涉及肺癌、黑色素瘤、肾癌、霍奇金淋巴瘤、头颈鳞癌、膀胱癌、结直肠癌、肝癌、胃癌9个瘤种。“据我所知,在我国,肝癌方面很快有相应适应证,在小细胞肺癌方面我们也正在做相关研究,也很可能会有新的适应证。所以,我相信纳武利尤单抗在美国获批的适应证,中国早晚也会取得。此外,还有一些中国人高发的癌症,比如说胃癌、食管癌,也有可能证明有效而获批。” 陆舜认为,纳武利尤单抗的快速获批以及国内大量进行中的临床试验表明,中国与国际新药上市的时间差已经在缩短,国内肿瘤患者有机会第一时间获得创新药物的治疗。
文章来源网络,如有侵权,请联系删除。
http://www.sohu.com/a/256301900_162422
同类文章排行
- 管好这三步,RET融合肺癌患者少走弯路,活得更长更好!
- EGFR突变患者进展了别慌,从耐药检测到治疗选择这样做能找到新出路
- 这种药会降低10倍生存期,请肺癌患者警惕使用!
- 免疫治疗对EGFR突变肺癌有效吗?
- 新型免疫细胞疗法TILS,仅一次治疗为晚期头颈癌患者带来“稳定”的希望!
- 晚期肺癌跨过9年!他坦白秘密:抗癌4大法宝里,这件事最有效
- 演员李菁菁瘦到认不出 曾患乳腺癌如今已战胜病魔
- 临床植入式电极精准定位脑深部肿瘤边界
- 当FDA超级加倍重视OS,能否影响肿瘤药物研发格局?
- 预后极差、治疗选择有限 HER2突变晚期非小细胞肺癌患者迎创新疗法
最新资讯文章
您的浏览历史