晚期黑色素瘤抗PD-1单抗治疗丨临床更新
自获批以来,抗PD-1单抗作为单一疗法或与ipilimumab联结合疗法已经成为晚期BRAF野生型黑色素瘤的标准一线治疗方法以及与一线治疗背景下不可切除BRAF突变型黑色素瘤靶向治疗相媲美的方案。最近,抗PD-1制剂的临床应用已经扩展至其他疾病,如切除的高危黑色素瘤,非皮肤亚型以及脑转移瘤。如何更好地抵抗抗PD-1单抗的耐药性仍是临床研究的主要焦点。
Pembrolizumab和nivolumab是两种抗PD-1单抗,最近,作为切除的高危黑色素瘤辅助治疗方案,抗PD-1制剂受到了广泛关注。正在进行的研究旨在了解并攻克免疫检查点制剂相关的原发性和继发性耐药性。
抗PD-1单药AM治疗临床应用
给药计划改变
Pembrolizumab和nivolumab的获批剂量分别为初始每3周2mg/kg(Q3W)和每2周3mg/kg(Q2W)。Nivolumab固定剂量(240mgQ2W)为3mg/kg×3,458例入组的多种肿瘤患者的中位体重77kg。由于群体药代动力学(PPK)模型证实了nivolumab固定剂量与基于体重的剂量之间相当的获益-风险概况,在美国,240mgQ2W方案被批准用于黑色素瘤和其他实体瘤治疗。最近,nivolumab每4周480mg(Q4W)显示出相似地平均稳态暴露和获益-风险概况。因此,该方案已被纳入正在进行的临床试验,正在获批审核中。另外,在美国,Pembrolizumab 200mg Q3W方案已被批准用于黑色素瘤和其他实体瘤治疗。
一线抗PD-1单抗生存数据更新
KEYNOTE-006
该开放标签,随机III期研究将834例AM患者(未经治疗或既往除CTLA-4或PD-1外全身治疗)以1:1:1的比例随机分为pembrolizumab 10mg/kg Q2W (n=279),pembrolizumab 10mg/kg Q3W (n=277), 或4剂 ipilimumab 3mg/kg Q3W
(n=278)治疗组。由于pembrolizumab较优的总生存(OS)结局,研究被提前终止。Ipilimumab可与pembrolizumab交叉治疗。
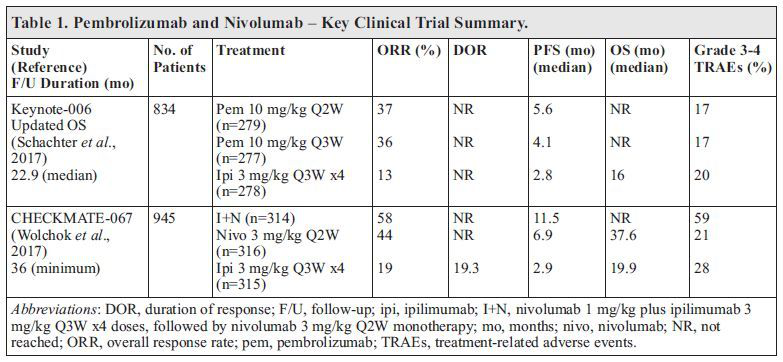
成熟生存结果与初始结果一致。中位随访22.9个月时,两个pembrolizumab组未达到中位OS(NR),ipilimumab组则为16个月[风险比(HR):0.68; 95%CI 0.53-0.87; p=0.0009(Q2W)或0.68; 95%CI 0.53-0.86; p=0.0008(Q3W)]。Pembrolizumab Q2W,pembrolizumab Q3W和ipilimumab组24个月OS率分别为55%(95%CI 49-61),55%(95%CI 49-61)和43%(95%CI 37-49)。两个pembrolizumab组之间OS无差异(HR 1.01; p=0.93)。Pembrolizumab优越的OS结局维持至随访33.9个月。接受pembrolizumab治疗的患者中位OS为32.3个月(95%CI 24.5-NR),ipilimumab对照组为15.9个月(95%CI 13.3-22.0)。根据基线乳酸脱氢酶(LDH),肿瘤负荷,BRAF状态和PD-L1表达,各重要亚组pembrolizumab OS获益一致。各治疗组抗肿瘤反应持久,中位持续时间NR。Pembrolizumab和ipilimumab的有效率分别为71%和65%。
CHECKMATE-067
最近,CHECKMATE-067试验OS数据也进行了更新。该双盲III期临床试验将945例未经治疗的AM患者以1:1:1的比例随机分为ipilimumab 3mg/kg+4剂 nivolumab 1mg/kg Q3W,然后nivolumab 3mg/kg Q2W (I+N 3/1计划, n=314);ipivimumab匹配安慰剂和nivolumab 3mg/kg Q2W (n=316);或4剂ipilimumab 3mg/kg Q3W+nivolumab匹配安慰剂(n=315)。
在对所有参与者进行至少36个月的随访中,应用含nivolumab的方案治疗的患者比ipilimumab组患者具有显着统计学意义的更长存活期。联合治疗组,Nivolumab和ipilimumab组的中位OS分别为NR(95%CI 38.2-NR),37.6个月(95%CI 29.1-NR)和19.9个月(95%CI 16.9-24.6)。根据基线LDH,肿瘤负荷,BRAF状态和PD-L1表达,各个关键亚组之间利于含nivolumab方案的生存获益一致。虽然最初并未比较联合治疗与nivolumab治疗组,但进行了描述性分析。联合治疗组和nivolumab组3年OS率分别为58%和52%(HR 0.85; 95%-CI 0.68-1.07)。基线LDH升高,BRAF突变或低PD-L1表达(<5%或<1%)亚组中,联合治疗组OS率在数值上高于nivolumab单药治疗组。肿瘤PD-L1表达≥1%或≥5%的患者中,联合治疗可能较单药nivolumab无OS优势。然而,PD-L1表达是OS不良预测性生物标志物。疾病控制持久。第三年,相较于nivolumab(45%)和ipilimumab(20%)组,联合治疗组中59%的患者未进行后续治疗。
AM治疗方案抗PD-1药物整合
KEYNOTE-006和CHECKMATE-067试验确立了抗PD1单克隆抗体的作用,既可以作为单药治疗,也可以与ipilimumab联合作为AM患者的一线治疗方案。目前,抗PD-1治疗失败后ipilimumab治疗疗效数据很少。Long及其同事简要描述了KEYNOTE-006试验中129例pembrolizumab治疗疾病进展后ipilimumab治疗患者的结局。二线ipilimumab治疗的97例患者中,64%患有M1c疾病,33% LDH升高,16%在基线时BRAF突变。后续ipilimumab总缓解率(ORR)为14%[3%完全缓解(CR)和11%部分缓解(PR)]。33%的患者疾病稳定(SD)。作为对比,KEYNOTE-006试验中一线ipilimumab治疗ORR为13%。因此,CTLA-4抑制剂可用于一线pembrolizumab进展性疾病患者。
Zimmer及其同事在多中心回顾性研究中尝试检测ipilimumab单药或ipilimumab-nivolumab的作用,I+N 3/1或ipilimumab 1mg/kg+nivolumab 3mg/kg (I+N 1/3) Q3W 4剂,然后维持nivolumab治疗。2010年1月1日至6月10日,47例患者接受ipilimumab单药治疗,37例患者接受随后的I+N(其中5名接受1+N 1/3)。Ipilimumab单药治疗中位随访时间为6个月(范围1-63),I+N为4个月(范围1-12)。由于进展(67%)或毒性(33%),联合治疗组中41%的患者接受剂量少于4剂。Ipilimumab组疾病控制率(CR+PR+SD)为42%,联合组为33%。Ipilimumab和I+N组中位无进展生存期(PFS)分别为3个月和2个月。Ipilimumab和I+N的一年OS率分别为54%和55%。Ipilimumab治疗患者ORR为16%,与CHECKMATE-067结果一致。I+N组ORR为21%,低于CHECKMATE-067一线背景下的ORR(58%)。初始抗PD-1治疗反应对随后ipilimumab反应无统计学意义[比值比(OR)1.45, 95%CI 0.4-5, p=0.55) 或I+N (OR 0.75, 95%CI 0.2-3.6, p=0.82)]。因此,ipilimumab作为二线药物可能具有相似地功效。目前正在招募患者进行初始PD-1/PD-L1抗体后pembrolizumab-ipilimumab联合治疗的前瞻性试验,因此需进一步检测双重检查点抑制剂作为二线治疗的活性。
当前,BRAF野生型AM患者一线抗PD-1治疗后接受二线ipilimumab治疗是广泛公认的顺序。BRAF突变型AM患者中,是否开始抗PD-1抗体或BRAF-MEK抑制剂组合一线治疗仍存在争议。最终答案需等待EA6134和SECOMBIT试验结果。
晚期非皮肤黑素瘤的疗效
粘膜黑色素瘤
抗PD-1药物在治疗晚期非皮肤黑素瘤如粘膜和葡萄膜黑素瘤方面的临床数据非常有限。晚期粘膜黑色素瘤(AMM)是一种侵袭亚型,主要起源于口腔或鼻窦腔,并常与c-KIT基因突变相关。为检测抗PD-1单抗在AMM中的疗效,Butler及其同事汇总了KEYNOTE-001, -002, 和-006试验中84例pembrolizumab(2mg/kg Q3W, 10mg/kg Q3W, 或10mg/kg Q2W)治疗的AMM患者数据。84例患者中,8%发生BRAFV600突变,70%PD-L1阳性表达,39%曾接受ipilimumab治疗。AMM中,pembrolizumab的ORR为19%,而皮肤AM为33%。AMM患者DCR为31%,而皮肤AM为47%。AMM患者中位PFS为2.8个月,中位OS为11.3个月。16位缓解患者中,缓解中位持续时间(DOR)为27.6个月。既往接受ipilimumab治疗的AMM患者ORR为15%,DCR为27%,中位DOR为27.6个月。因此,pembrolizumab治疗的AMM患者出现缓解。
D'Angelo及其同事还对接受3mg/kg Q2W (n=86 5项试验) 或者 I+N 3/1 (n=35 2项试验)nivolumab单药治疗的AMM患者进行了汇总分析。AMM nivolumab单药治疗中位PFS为3.0个月(95%CI 2.2-5.4),皮肤AM为6.2个月(95%CI 5.1-7.5)(n=665)。AMM患者中,nivolumab单药ORR为23.3% (95% CI 14.8-33.6) ,皮肤AM ORR为40.9% (95% CI 37.1-44.7)。1+N时,AMM(n=35)中位PFS为5.9个月(95%CI 2.8-NR),皮肤AM为11.7个月(95%CI 8.9-16.7)。组合治疗时,AMM ORR为37.1% (95% CI 21.5-55.1),皮肤AM ORR为60.4% (95% CI 54.9-65.8)。一般而言,AMM抗PD-1治疗可能较皮肤AM疗效差。
葡萄膜黑色素瘤
葡萄膜黑色素瘤(UM)由少于5%的所有黑素瘤组成。UM患者预后差,其中50%发生转移,尤其是肝脏转移。目前,晚期UM(AUM)患者尚未确立全身治疗方案。Karydis及其同事回顾性分析了2014年6月1日至2015年8月1日,25例ipilimumab预处理的AUM患者pembrolizumab 3 mg/kg Q2W的疗效和安全性。25名患者中无一人对既往ipilimumab出现客观缓解。在数据截止时间,患者接受中位数6个周期的pembrolizumab治疗,其中两位患者仍在接受治疗。中位随访225天,中位PFS为91天,中位OS为NR。2例(8%)达到PR,6例(24%)SD多于3个月。仅基线时发生肝转移的疾病进展患者PFS较短,OS较差。Pembrolizumab可以达到AUM患者的疾病控制;然而,其活性较在皮肤AM或AMM中较差。一项多中心II期临床试验AUM患者pembrolizumab治疗疗效(预计将于2019年3月完成)。
脑转移瘤治疗疗效
KEYNOTE-006和CHECKMATE-067试验排除了脑转移患者,因此,对于抗PD-1抗体在颅内的活性了解甚少。Parakh等人的回顾性研究说明了抗PD-1试剂抗黑色素瘤脑转移的功效。应用pembrolizumab(91%)或nivolumab(9%)治疗了66例脑转移患者。大多数患者(90%)有≥2个脑损伤,所有靶标损伤的最长直径中值总和为23.5mm(范围5-153mm)。20例患者(30%)出现症状性IC病,15例需要应用皮质类固醇激素控制抗PD-1治疗初始症状。大多数患者(79%)接受≥1线既往全身治疗,64%接受局部脑转移治疗。中位随访7个月,IC缓解率和DCR分别为21%和56%。缓解患者中,3名患者出现症状性IC疾病。中位IC PFS为5.3个月(95%CI 3.3-8.2)。症状IC病患者的IC PFS显着低于无症状者,分别为2.7个月和7.4个月(p = 0.035)。中位OS为9.9个月(95%CI 6.9-17.7个月)。症状性IC疾病患者的OS比无症状患者短,分别为5.7和13.0个月(p = 0.068)。
目前正在进行评估AM患者脑内转移抗PD-1单克隆抗体疗效的前瞻性II期临床试验。18例既往未经治疗的脑转移瘤患者pembrolizumab 10mg / kg Q2W II期研究初步结果显示,所有PR的IC反应率为22%。除神经学不良事件外,pembrolizumab的安全性与既往数据一致,17% 1/2级癫痫发作和6% 3级认知功能障碍。
CHECKMATE-204是一项评估黑色素瘤脑转移患者I + N 3/1的II期临床研究。75例可评估未经治疗的无症状脑转移患者IC反应为55%(95%-CI 43-66)。中位随访9.2个月,IC反应持续时间尚未达到,6个月IC PFS为67%。CHECKMATE-204成熟数据尚未出炉,研究已扩展至包括需要皮质类固醇治疗的症状性脑转移患者。
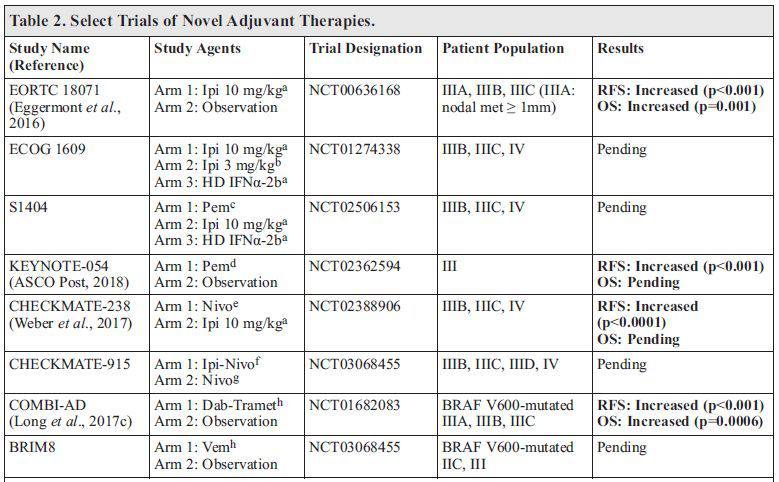
抗PD-1药物作为切除后高危黑色素瘤患者的辅助治疗方案
最近,美国批准nivolumab+高剂量干扰素-α/聚乙二醇化IFNα和ipilimumab作为切除后高危黑色素瘤患者的辅助治疗选择。CHECKMATE-238试验将切除的IIIB,IIIC或IV期黑色素瘤患者随机分为一年nivolumab, 3mg/kg Q2W (n=453),或4剂ipilimumab, 10mg/kg Q3W然后每12周(Q12W) (n=453)组。主要终点为无复发生存期(RFS),次要终点包括OS,安全性和生活质量。随访至少18个月的中期分析中,nivolumab组12个月RFS率为70.5%,ipilimumab组为60.8%(HR:0.65,p <0.001)。关于疾病分期,肿瘤PD-L1表达,BRAF突变,淋巴结受累程度和原发病灶溃疡状态,亚组分析中RFS结果一致。两组均未达到RFS中位数和无远处转移生存率(探索性终点)。
nivolumab的安全性数据更为有利,nivolumab治疗组3/4级治疗相关不良事件(TRAEs)发生率为14.4%,ipilimumab治疗组为45.9%。nivolumab给药剂量中位数为24,ipilimumab为4。Nivolumab和ipilimumab组因TRAE而停药的比率分别为9.7%和42.6%。Nivolumab组未出现与治疗有关的死亡,而两例ipilimumab治疗患者死于治疗相关并发症(骨髓发育不良和结肠炎)。
目前正在进行pembrolizumab或ipilimumab-nivolumab结合辅助治疗试验。中期分析时KEYNOTE-054初步结果证实,相较于安慰剂,佐剂pembrolizumab显著改善了PFS。另外,完全切除IIIB,IIIC,IIID或IV黑色素瘤后,比较了ipilimumab-nivolumab组合与nivolumab单一疗法的疗效。
抗PD-1抗体组合治疗以克服耐药性
尽管抗PD-1制剂在AM中具有显著的抗肿瘤活性,但是50-60%的患者对一线nivolumab或pembrolizumab治疗无反应(从头或主要耐药:患者的黑素瘤未对抗PD -1疗法反应)。反应者中,中位随访22.9个月时出现第三种最终进展(获得性耐药:患者的黑素瘤最初对抗-PD-1治疗反应但最终进展)。因此,目前大量的研究工作致力于理解和攻克耐药性。耐药机制包括免疫识别缺陷,T细胞效应分子不敏感,免疫抑制性肿瘤微环境,肿瘤干细胞,肠微生物组以及共择替代免疫检查点。这些临床前数据为合理研发攻克抗PD-1耐药性组合策略奠定了基础。
与其他免疫检查点抗体组合
多种刺激性和抑制性免疫检查点分子协同调节免疫力。刺激性分子结合,如4-1BB和OX-40增强了细胞毒性T细胞的功能,增殖和存活,并且可能弥补抗PD-1单抗引发的抗肿瘤免疫应答。PD-1/PD-L1共抑制与其他抑制性受体,如CTLA-4,LAG-3,和TIM-3协同作用,进一步增强T细胞活化,逆转T细胞耗竭。迄今为止,双重抑制性检查点抑制剂取得了进展并已应用于临床,而抗PD-1药物与免疫刺激受体激动剂结合仍处于临床开发的早期阶段。
截至目前,最成功的方案为抗CTLA-4与抗PD-1抗体联用,ipilimumab-nivolumab已获批用于AM患者一线治疗。值得注意的是,当前批准的组合剂量为I+N 3/1。然而,该方案的毒性非常显着,59%的患者出现3/4级TRAE。由于I+N 1/3方案安全性较好,因此在3/4级TRAE为46%的情况下,3b/4期随机双盲研究在对I+N 1/3与I+N 3/1进行了头对头比较。
KEYNOTE-029试验评估了153例AM患者标准剂量Pembrolizumab与ipilimumab 1mg/kg治疗疗效。所有患者随访至少12个月。3/4级TRAE和免疫相关不良事件(irAEs)发生率分别为45%和27%。14%的患者因TRAE停服两种药物,仅8%的患者停药ipilimumab,仅9%停药pembrolizumab。ORR为61%,一年PFS和OS率分别为69%和89%。固定剂量Pembrolizumab,200mg Q3W和每6周ipilimumab, 50mg或100mg Q12W,最多4剂ipilimumab组合方案正在进一步研发中。
与吲哚胺-2,3-双加氧酶(IDO)抑制剂联用
IDO是色氨酸分解代谢的限速酶,色氨酸消耗和犬尿氨酸生成抑制了效应T细胞功能并促进调节性T细胞分化,从而调节外周耐受。该生物学过程可被肿瘤细胞劫持以逃避免疫监视。IDO过度表达与许多人类癌症预后不良有关。抗PD-1治疗后肿瘤中IDO表达上调与晚期头颈部肿瘤患者疾病进展相关。IDO抑制剂与临床前模型中CTLA-4或PD-1/PD-L1阻断抑制剂抗肿瘤作用协同作用。这些发现促进了IDO抑制剂与检查点抑制剂联合用于癌症治疗的临床研究。目前,正在研发5种IDO抑制剂:epacadostat,indoximod(D-1MT),BMS-986205,navoximod(GDC-0919,NLG 919)和HTI-1090。
与溶瘤病毒疗法联用
抗PD-1治疗主要耐药的重要机制为部分患者出现非炎性肿瘤表型,以不存在T细胞浸润和I型干扰素标志为特征。瘤内talimogene laherparepvec(T-VEC)与检查点抑制剂结合,可能将T细胞募集至肿瘤微环境中。
MASTERKEY-265 1b/3期试验中,T-VEC的瘤内给药与pembrolizumab 200mg Q2W结合(始于三次T-VEC注射)用于既往未经治疗的不可切除IIIB-IV期黑色素瘤以及至少存在一个可注射病灶的患者。纳入21例患者的1b期部分数据证实了该组合的安全性和耐受性。最常见的TRAE为疲劳,寒战和发热,38%的患者可见3/4级TRAE。3例患者出现严重irAE,肝炎,无菌性脑膜炎和肺炎各1例。该组合ORR和CR率分别为61.9%(95%CI 38.4-81.9)和33.3%(95%CI 14.6-57.0)。82%的注射病灶,43%的非注射、非内脏病灶以及33%的非注射内脏病灶出现> 50%的肿瘤消退。中位随访18.6个月,中位PFS和OS尚未达到。治疗反应与T-VEC导入后肿瘤CD8+T细胞和IFNg基因表达增加呈正相关。III期试验正在评估660例患者T-VEC-pembrolizumab与安慰剂-pembrolizumab治疗疗效。
文章编译自:VanAnh Trinh. Anti-Programmed Cell Death-1 (PD-1) Monoclonal Antibodies in Treating Advanced Melanoma — A Clinical Update. Discovery Medicine 2018.
文章来源网路,如有侵权,请联系删
同类文章排行
- 广泛期小细胞肺癌二线治疗新进展:安罗替尼+伊立替康,能带来哪些新希望?
- 全球首个针对DLL3的三特异性抗体与创新双抗药联合治疗小细胞肺癌,获批临床试验
- 奥希替尼耐药后怎么办?EGFR突变非小细胞肺癌患者的“第二战场”:埃万妥单抗?
- 肺癌没法手术?神药DS-8201+免疫治疗“逆转困局”真实案例!9个月无复发!
- 近40%胃癌患者的新希望!Satri-cel首次让CAR-T治疗实体瘤取得“硬胜利”
- 免疫治疗正在改变癌症治疗,但高血糖风险需要警惕
- EBC-129:靶向CEACAM5/6的新型ADC,为胰腺癌治疗打开新局面!
- 免疫治疗必读:下午3点前用药效果最佳!无进展生存期翻倍!
- 面对奥希替尼耐药,Necitumumab的加入能否逆转局面?
- HER2突变型晚期非小细胞肺癌脑转移的生存及预后因素
最新资讯文章
您的浏览历史